- Эпидемиология
- Морфологическая классификация
- Метастазирование
- TNM классификация рака почки
- Факторы прогноза
- Клинические проявления рака почки
- Диагностика и стадирование рака почки
- Хирургическое лечение локализованного рака почки
- Лимфаденэктомия при раке почки
- Хирургическое лечение рака почки с опухолевым тромбозом почечной и нижней полой вены
- Осложнения радикальной нефрэктомии
- Органосохраняющее лечение при раке почки
- Общие положения
- Осложнения
- Хирургическое лечение солитарных и единичных метастазов рака почки
- Хирургическое лечение местных рецидивов после нефрэктомии
- Лекарственное лечение метастатического рака почки
- Химиотерапия
- Гормональная терапия
- Иммунотерапия
- Заключение
C64 Злокачественное новообразование почки, кроме почечной лоханки, МКБ-10
Отредактировано: 02.04.2024
д.м.н. Матвеев В.Б.
ГУ РОНЦ им. Н.Н. Блохина РАМН
Эпидемиология. Морфологическая классификация. TNM классификация рака почки. Факторы прогноза. Клинические проявления рака почки. Диагностика и стадирование рака почки. Хирургическое лечение локализованного рака почки. Органосохраняющее лечение при раке почки. Хирургическое лечение солитарных и единичных метастазов рака почки. Лекарственное лечение метастатического рака почки. Лучевая терапия при костных метастазах рака почки. Бисфосфонаты
Эпидемиология
Несмотря на огромное количество исследований, посвященных раку почки, этиология этой формы опухолей до сих пор не ясна. Однако выделено несколько групп факторов риска, способствующих развитию данного новообразования.
Рак почки занимает 10-е место по уровню заболеваемости среди злокачественных новообразований. С 1992 по 1998 г. заболеваемость данным видом опухоли в России возросла с 6,6 до 9,0 на 100 тыс. населения. Данные о смертности при раке почки в нашей стране отсутствуют. В США в течение 1998 г. было зарегистрировано 30 тыс. новых случаев заболевания, при этом опухоль почки послужила причиной смерти 12 тыс. человек.
Пол и возраст
Заболеваемость почечно-клеточным раком зависит от возраста и достигает максимума к 70 годам. Мужчины страдают данной патологией в 2 раза чаще, чем женщины.
Курение
На сегодняшний день доказано, что курение табака является одним из наиболее значимых факторов риска развития различных злокачественных новообразований. Риск появления опухоли почки у курильщиков обеих половых групп возрастает с 30 до 60% по сравнению с некурящим населением. При отказе от курения вероятность развития заболевания снижается. По данным ряда когортных международных исследований, в течение 25 лет после отказа от курения риск появления рака почки снижается на 15%.
Ожирение
В большинстве исследований подтверждено неблагоприятное влияние чрезмерной массы тела на вероятность развития рака почки. Ожирение приводит к увеличению частоты заболеваемости почечно-клеточным раком на 20%. Колебания веса, а также значительное увеличение массы тела у взрослых являются независимыми факторами риска развития данной патологии. Механизм влияния ожирения на развитие рака почки до сих пор не ясен. Возможно, это связано с увеличением концентрации эндогенных эстрогенов и/или с биологической активностью инсулиноподобных факторов роста.
Артериальная гипертензия
В нескольких эпидемиологических исследованиях было отмечено увеличение риска развития рака почки у больных артериальной гипертензией на 20%. Остается открытым вопрос, является ли причиной развития почечно-клеточного рака собственно гипертензия или развитие опухоли потенцируется применением разнообразных гипотензивных препаратов.
Лекарственные препараты
Многие авторы связывают появление почечно-клеточного рака с использованием диуретических препаратов. Риск развития данной патологии у больных, получавших мочегонные средства по различным показаниям, составляет более 30%. Было установлено, что в значительной степени риск развития рака почки увеличивают препараты, содержащие амфетамин. В литературе имеются немногочисленные сообщения о том, что вероятность заболевания опухолью почки увеличивает прием фенацетин-содержащих анальгезирующих средств.
Заболевания почек
В больших эпидемиологических исследованиях не было выявлено достоверного увеличения частоты заболеваемости раком почки у больных мочекаменной болезнью и пациентов с кистами почек. Отмечен повышенный риск развития почечно-клеточного рака при терминальной стадии хронической почечной недостаточности.
Сахарный диабет
В ряде работ отмечено увеличение заболеваемости почечно-клеточным раком у больных, страдающих сахарным диабетом. Однако показатели смертности от рака почки в данной группе аналогичны таковым в популяции. Тесная взаимосвязь между сахарным диабетом, ожирением и гипертензией затрудняет оценку истинного влияния каждого из этих заболеваний на частоту развития опухолей почки.
Репродуктивные и гормональные факторы
Потенциальное патогенетическое значение гормональных факторов в развитии рака почки доказано на животных моделях. В здоровой и малигнизированной тканях почки животных моделей выявлены рецепторы половых гормонов. Получены данные о возможности развития эстроген-индуцированной аденомы и карциномы почки у хорьков.
Питание
В эпидемиологических исследованиях отмечена корреляция частоты возникновения рака почки с употреблением мяса, растительных продуктов, а также маргарина и масла. Однако достоверного влияния конкретных продуктов питания на заболеваемость почечно-клеточным раком не выявлено. Возможно, патогенетическое значение имеют не сами исходные продукты, а вещества, выделяющиеся при приготовлении пищи. Доказанным канцерогенным эффектом обладают пиролизисные составляющие, в частности, гетероциклические амины, вырабатывающиеся при высокотемпературной обработке мяса. Употребление овощей и фруктов, по данным большинства авторов, способствует снижению риска развития рака почки. Влияние употребления алкоголя, кофе и чая на заболеваемость опухолями почки не изучено.
Профессия
Почечно-клеточный рак не является профессиональным заболеванием. Однако опубликованы данные о повышенном риске развития данной патологии у лиц, занятых на ткацком, резиново-каучуковом, бумажном производстве, имеющих контакт с промышленными красителями, нефтью и ее производными, промышленными ядохимикатами и солями тяжелых металлов.
Морфологическая классификация
В основе традиционных классификаций рака почки лежат особенности морфологии клетки и клеточного ядра. Современные классификации учитывают данные морфологических, цитогенетических и молекулярных исследований и выделяют 5 видов рака почки:
- Светлоклеточный — 60–85%.
- Хромофильный (папиллярный) — 7–14%.
- Хромофобный — 4–10%.
- Онкоцитарный — 2–5%.
- Рак собирательных протоков — 1–2%.
О прогностической значимости различных вариантов почечно-клеточного рака будет сказано ниже.
Метастазирование
Рак почки метастазирует гематогенным и лимфогенным путем. На момент установления диагноза метастазы обнаруживаются у 25% пациентов. Выживаемость данных больных составляет от 6 до 12 мес, и только 10% переживают 2 года. Приблизительно у 30–50% больных в различные сроки после нефрэктомии появляются метахронные метастазы. Прогноз последней группы несколько лучше, однако 5-летняя выживаемость не превышает 9%. По данным Saitoh et al. (1982), наиболее частыми локализациями множественных метастазов являются легкие — 76%, лимфатические узлы — 64%, кости — 43%, печень — 41%, ипсилатеральный и контралатеральный надпочечник 19% и 11,5%, контралатеральная почка 25%, головной мозг 11,2%. Солитарные метастазы или метастатическое поражение только одного органа имеют место только в 8–11% случаев.
Говоря о течении метастатической болезни при раке почки, нельзя не упомянуть о случаях спонтанной регрессии и стабилизации. Спонтанная регрессия отмечается у 0,4–0,8% больных раком почки. Это касается в подавляющем большинстве случаев регрессии легочных метастазов. Стабилизация болезни, определяемая как отсутствие роста и появления новых метастазов, наблюдается у 20–30% больных. С такой же частотой отмечается стабилизация болезни (отсутствие роста первичной опухоли) у больных раком почки без метастазов. Этот феномен должен учитываться при решении вопроса о хирургическом или системном лечении больных с высоким риском, которые в действительности могут прожить дольше без всякого лечения.
TNM классификация рака почки
Почечно-клеточный рак характеризуется весьма вариабельным клиническим течением, что обусловлено генетической гетерогенностью и морфологическим разнообразием данной группы опухолей.
В настоящее время в России, как и во многих странах, используется TNM классификация, предложенная Международным противораковым союзом, подробно освещающая степень распространенности опухолевого процесса с целью определения лечебной тактики.
TNM клиническая классификация почечно-клеточного рака (2002)
Критерий Т (первичная опухоль):
Тх — первичная опухоль не может быть оценена;
Т0 — нет данных о первичной опухоли;
Т1 — опухоль не более 7 см в наибольшем измерении, ограниченная почкой;
T1a — опухоль до 4 см;
T1b — опухоль 4–7 см;
Т2 — опухоль более 7 см в наибольшем измерении, ограниченная почкой;
Т3 — опухоль распространяется в крупные вены, или инвазирует надпочечник, или окружающие ткани, но не выходит за пределы фасции Герота;
Т3а — опухолевая инвазия надпочечника или паранефральной клетчатки в пределах фасции Герота;
Т3b — опухоль распространяется в почечную вену или нижнюю полую вену ниже диафрагмы;
Т3с — опухоль распространяется в нижнюю полую вену выше диафрагмы или инвазирует ее стенку;
Т4 — опухоль распространяется за пределы фасции Герота.

Рисунок 1. Схематическое изображение стадий T1 и T2
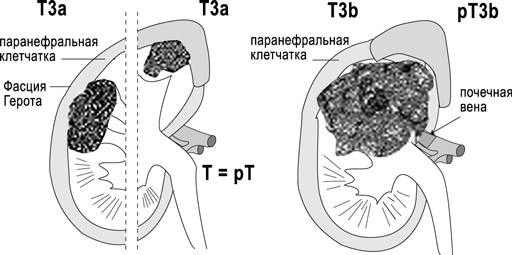
Рисунок 2. Схематическое изображение стадий T3a и T3b
Критерий N (регионарные лимфатические узлы):
Nх — регионарные лимфатические узлы не могут быть оценены;
N0 — нет метастазов в регионарных лимфатических узлах;
N1 — метастаз в одном регионарном лимфатическом узле;
N2 — метастазы более, чем в одном регионарном лимфатическом узле.
Критерий М (отдаленные метастазы):
Мх — отдаленные метастазы не могут быть оценены;
М0 — нет отдаленных метастазов;
М1 — отдаленные метастазы.
Критерии pTNM (патологоанатомическая классификация):
pT, pN и pM критерии соответствуют T, N и М критериям.
Критерий G (гистопатологическая градация):
Gх — степень дифференцировки не может быть оценена;
G1 — высоко дифференцированная опухоль;
G2 — умеренно дифференцированная опухоль;
G3–4 — низко дифференцированная/недифференцированная опухоль.
Таблица 1
Группировка по стадиям
| Стадия I | T1 | N0 | M0 |
| Стадия II | T2 | N0 | M0 |
| Стадия III | T1 | N1 | M0 |
| T2 | N1 | M0 | |
| T3 | N0, N1 | M0 | |
| Стадия IV | T4 | N0, N1 | M0 |
| любая T | N2 | M0 | |
| любая T | любая N | M1 |
Факторы прогноза
Клинические факторы
Одним из важнейших направлений современной онкоурологии является выделение факторов, позволяющих составить индивидуальный прогноз и определить оптимальную тактику лечения больных раком почки.
По данным ряда авторов, прогностически неблагоприятным являются:
- Общее тяжелое состояние больного.
- Наличие клинических симптомов заболевания на момент установления диагноза.
- Снижение массы тела более, чем на 10%.
Напротив, возраст, пол и национальность не влияют на прогноз.
В ряде исследований продемонстрировано достоверное неблагоприятное влияние на выживаемость увеличения скорости оседания эритроцитов (СОЭ), повышенный уровень сывороточных гаптоглобина, ферритина, C-реактивного белка, орозомукоида, альфа1-антитрипсина, ИЛ–6.
У больных диссеминированным почечно-клеточным раком прогностическое значение имеют:
- Анемия.
- Гиперкалиемия.
- Гипоальбуминемия.
- Повышение уровня щелочной фосфатазы сыворотки крови.
Показано влияние на исход заболевания уровня следующих факторов: хромогранина А, нейронспецифической энолазы (NSE), ракового антигена 125 (СА125), опухоль-ассоциированного ингибитора трипсина (TATI) и эндогенного эритропоэтина (ЭП). В настоящее время проводятся исследования, посвященные изучению генетических маркеров в крови и моче, которые могут позволить составить индивидуальный прогноз больных раком почки.
Патоморфологические факторы
Стадия опухолевого процесса (Т), отражающая анатомическую распространенность новообразования, является наиболее значимым фактором прогноза при раке почки. Пациенты с опухолью, ограниченной почкой, имеют лучший прогноз. Инвазия за пределы капсулы Герота (T3a) уменьшает выживаемость на 27%, наличие опухолевого тромбоза почечной и нижней полой вен (T3b-c) — на 40% (табл. 2, рис. 3).
Таблица 2
Выживаемость 2507 больных раком почки в зависимости от стадии T (Давыдов М.И., Матвеев В.Б., собственные данные)
| Стадия T | 5-летняя выживаемость, % |
| I | 75,8 |
| II | 66,8 |
| IIIa | 39 |
| IIIb-c | 25,7 |
| IV | 14,3 |

Рисунок 3. Выживаемость 2507 больных раком почки в зависимости от стадии T (Давыдов М.И., Матвеев В.Б., собственные данные)
Инвазия в коллатеральные вены и капилляры также является неблагоприятным фактором прогноза.
Наличие метастазов в лимфатические узлы у больных раком почки ассоциировано с крайне плохим прогнозом: 5 лет переживают от 5 до 30% пациентов (рис. 4).
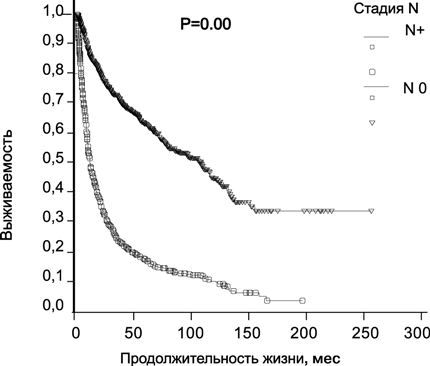
Рисунок 4. Выживаемость 2507 больных раком почки в зависимости от стадии N (Давыдов М.И., Матвеев В.Б., собственные данные)
Появление отдаленных метастазов резко ухудшает прогноз при раке почки. 5-летняя выживаемость больных диссеминированным раком почки составляет 14,6%, что достоверно меньше, чем в группе пациентов с локализованной опухолью (57,3%) (р=0,0000) (рис. 5).

Рисунок 5. Выживаемость 2507 больных раком почки в зависимости от стадии M (Давыдов М.И., Матвеев В.Б., собственные данные)
При наличии отдаленных метастазов стадия Т почечно-клеточного рака прогностического значения не имеет.
Бóльшая продолжительность жизни при диссеминированном почечно-клеточном раке наблюдается при метахронном появлении метастазов и солитарных опухолевых очагах, локализующихся в одном органе. Одним из наиболее важных прогностических факторов является возможность радикального удаления всех определяемых метастазов.
Гистопатоморфологические признаки
Большинство современных гистологических классификаций принимают во внимание морфологические признаки клеточного ядра, которые являются независимыми факторами прогноза, занимающими второе место по значимости после стадии заболевания. 5-летняя выживаемость пациентов с опухолями G1 составляет 76%, G2 — 72%, G3 — 51%, G4 — 35%.
Плоидность ДНК коррелирует с целлюлярной кинетикой почечно-клеточного рака: в диплоидных опухолях отмечается более низкий уровень фракции клеток, находящихся в S-фазе, а также более продолжительное время удвоения опухоли, чем в анеуплоидных клонах, что ассоциировано с благоприятным прогнозом.
На выживаемость больных раком почки влияет митотический индекс. Выявлено, что при наличии менее 1 фигуры митоза на 10 полей зрения при малом увеличении 10-летняя выживаемость составляет 67%, более 1 — 16%.
Генетические факторы
Как было отмечено выше, современные классификации рака почки учитывают не только морфологические, но и цитогенетические особенности опухоли, обуславливающие различное клиническое течение.
Традиционный (не папиллярный) рак составляет 75% всех эпителиальных опухолей почки и характеризуется наличием делеции хромосомы 3р. Только в опухолях данного типа имеет место мутация гена VHL. Данный тип рака почки имеет более высокий метастатический потенциал и отличается худшей выживаемостью по сравнению с папиллярной и хромофобной формами.
При папиллярной форме рака почки обычно выявляется комбинация трисомий по 7; 17; 3q; 8; 12; 16 и 20 хромосомам, а также утрата Y-хромосомы. Папиллярная карцинома часто бывает двухсторонней и мультифокальной, ассоциирована с лучшей выживаемостью, чем традиционный, но худшей, чем хромофобный тип опухоли.
Для хромофобного рака характерно уменьшение количества хромосом в сочетании с гетерозиготностью по хромосомам 1; 2; 6; 10; 13; 17; 21; X и гипоплоидным содержанием ДНК. Данная форма почечно-клеточного рака имеет низкий метастатический потенциал. Выживаемость больных хромофобными опухолями больше, чем в группе пациентов с папиллярной и традиционной формами рака почки.
Рак собирательных протоков является редкой опухолью, составляющей 1–2% всех случаев почечно-клеточного рака. Рак собирательных протоков является очень агрессивной опухолью с высоким метастатическим потенциалом.
Таким образом, генетические альтерации детерминируют туморогенез и степень злокачественности опухолевого процесса при различных формах почечно-клеточного рака.
Факторы регуляции клеточного цикла
В ряде исследований отмечено прогностическое значение изменений, происходящих в системе регуляции клеточного цикла в процессе развития опухоли. Система регуляции клеточного цикла представлена особыми протеинами (циклины, циклин-зависимые киназы (CDK), CDK-ингибиторы и специфические фосфорилированные и нефосфорилированные субстраты). Белки-регуляторы клеточного цикла являются продуктами экспрессии протоонкогенов. Трансформация протоонкогена в онкоген является одной из ключевых аберраций туморогенеза, приводящей к нарушению регуляции клеточного цикла, обуславливающему повреждение механизмов контроля за клеточным ростом, пролиферацией и апоптозом.
Факторы ангиогенеза
Ангиогенез является важнейшим фактором, определяющим прогрессию опухоли и оказывающим существенное влияние на прогноз больных почечно-клеточным раком. Увеличение новообразования более, чем на 1 мм, требует появления новых сосудов. Существенную роль в туморогенезе играет сосудистый эндотелиальный фактор роста — VEGF. В настоящее время проводятся исследования, посвященные изучению прогностической роли других факторов — ФНО-альфа, основного фактора роста фибробластов (bFGF) и ингибиторов ангиогенеза (ангиостатина, ФНО-бета).
Клинические проявления рака почки
Классическая триада симптомов, описываемая ранее при раке почки у 15% больных (боль, макрогематурия и пальпируемая опухоль), в настоящее время встречается редко. В большинстве случаев заболевание протекает бессимптомно.
Клинические проявления возникают в основном на поздних стадиях. Среди местных симптомов наиболее часто отмечаются боль и гематурия. Боли в пояснице и животе возникают при инвазии или компрессии растущей опухолью окружающих структур, а также при почечной колике, обусловленной окклюзией мочеточников сгустками крови. Острая боль может быть следствием кровоизлияния в опухоль или ее разрыва с формированием забрюшинной гематомы. Прощупываемая опухоль — третий местный симптом рака почки, который бывает положительным у 12–15% пациентов на момент установления диагноза. Появление варикоцеле отмечают до 3,3% больных.
Артериальная гипертензия — непостоянный симптом (вызываемый сдавлением сегментарных артерий, окклюзией мочеточника, метастазами в головной мозг, формированием артериовенозных шунтов или повышенной секрецией опухолью ренина) наблюдается у 15% больных раком почки.
Синдром сдавления нижней полой вены (отеки ног, варикоцеле, расширение подкожных вен живота, тромбоз глубоких вен нижних конечностей, протеинурия) развивается у 50% больных при опухолевом тромбозе НПВ или при компрессии НПВ опухолью и увеличенными лимфатическими узлами.
Рак почки характеризуется большим разнообразием паранеопластических синдромов, наблюдаемых более, чем у половины больных. Одной из функций нормальной почечной паренхимы является продукция различных биологически активных веществ (ЭП, ренин, ПГ, простациклины, тромбоксаны, образование активной формы витамина D). Наличие опухоли может приводить к повышенной секреции вышеуказанных субстанций либо к продукции других гормонов, таких как паратгормон, инсулин, глюкагон, человеческий ХГ. В результате у пациентов могут возникать артериальная гипертензия, эритроцитоз, гиперкальциемия, гипертермия и др. Появление вышеуказанных симптомов может быть единственным проявлением заболевания и должно настораживать врача в отношении возможного опухолевого поражения почек. После радикального удаления опухоли паранеопластические проявления, как правило, исчезают, но могут возникнуть вновь при развитии местного рецидива или отдаленных метастазов. Таким образом, клинические проявления паранеопластического синдрома могут быть использованы для мониторинга заболевания.
Редкой формой паранеопластического синдрома является амилоидоз (1,7%). Сохраняющийся после нефрэктомии амилоидоз является крайне неблагоприятным фактором прогноза.
До сих пор непонятным остается возникновение в ряде случаев печеночной недостаточности при отсутствии метастатического поражения печени. При этом у больных раком почки отмечается гипоальбуминемия, повышение щелочной фосфатазы (ЩФ), лейкопения, лихорадка, возможно появление очагов некроза печеночной паренхимы (синдром Штафера). Восстановление функции печени после нефрэктомии является благоприятным прогностическим признаком.
Особенное место в клинической картине рака почки занимают симптомы, обусловленные метастазированием, т.к. более 25% больных на момент установления диагноза уже имеют отдаленные метастазы. Первыми проявлениями поражения легких являются кашель и кровохарканье. Костные метастазы могут манифестировать болевым синдромом, развитием патологических переломов, компрессией спинного мозга, появлением пальпируемой опухоли. Поражение головного мозга сопровождается быстрым появлением и нарастанием неврологической симптоматики. Множественные метастазы в печень могут проявляться желтухой.
Общие симптомы: анемия, высокая СОЭ, потеря аппетита, похудание, слабость — являются признаками поздних стадий заболевания.
Диагностика и стадирование рака почки
В результате появления современных неинвазивных диагностических методов, таких как УЗКТ, РКТ, МРТ, алгоритм обследования больных раком почки изменился. Наиболее часто опухоль почки обнаруживают при УЗКТ, выполняемой по поводу другого заболевания. Несмотря на высокую диагностическую ценность УЗКТ, последняя всегда должна быть дополнена РКТ, которая является основным методом диагностики объемных образований почки (рис. 6).

Рисунок 6. Алгоритм диагностики опухолей почки
Ангиография и выделительная урография уже не являются рутинными методами обследования больных локальным раком почки и не используются часто. В комплекс обязательных обследований для диагностики и стадирования входят РКТ, УЗКТ, рентгенография легких. Радиоизотопное сканирование скелета показано при наличии болей в костях и повышении ЩФ (рис. 7).
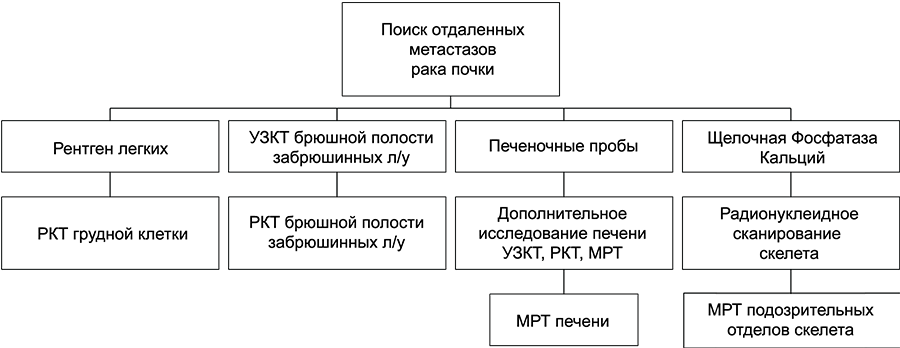
Рисунок 7. Алгоритм стадирования рака почки
МРТ выполняется больным с аллергией на йодсодержащие контрастные вещества, хронической почечной недостаточностью, опухолевым тромбозом НПВ, а также для подтверждения наличия костных метастазов. Радионуклидная ренография выполняется для оценки функционального состояния пораженной и здоровой почек, что может иметь большое значение при решении вопроса о тактике лечения.
Экскреторная урография
Процедура ранее традиционно применялась для выявления опухолей почек и оценки функции контралатеральной почки. Характерными признаками объемного образования считаются:
— увеличение размеров;
— деформация контуров;
— наличие кальцификатов;
— деформация чашечно-лоханочной системы;
— “ампутация” одной или нескольких чашечек;
— медиализация мочеточника.
Если диагноз опухоли почки был установлен при УЗКТ или РКТ, экскреторная урография не дает дополнительной информации для стадирования. Однако процедура показана больным с макрогематурией для проведения дифференциального диагноза с папиллярными образованиями верхних мочевыводящих путей.
УЗКТ, УЗКТ почек с использованием 3,5 и 5-MHz линейных датчиков
Методика позволяет не только диагностировать объемное образование почки, но и провести дифференциальный диагноз между простой кистой, комплексной кистой и сóлидной опухолью. Другими достоинствами метода являются его низкая стоимость, отсутствие побочных эффектов и возможность использования в скрининговых программах, целесообразность которых пока не доказана. Недостатками УЗКТ являются зависимость результатов от квалификации врача, недостаточно хорошая визуализация у тучных больных и при большом скоплении газа в кишечнике. Точность УЗКТ в выявлении малых (<3 см) опухолей почки составляет 79% по сравнению с 67% при использовании экскреторной урографии. Дифференциальный диагноз между опухолью менее 3 см в диаметре и ангиомиолипомой невозможен в 32% случаев. Использование Доплеровского датчика позволяет определить гиперваскуляризацию, более характерную для злокачественной опухоли, однако данный критерий не является надежным, т.к. до 20% раков почки гипо— или аваскулярны. Бесспорными достоинствами метода являются: возможность интраоперационной диагностики распространенности опухоли при выполнении резекции почки, определения протяженности опухолевого тромбоза НПВ, оценки распространенности поражения печени (рис. 8).

Рисунок 8. Ультразвуковая томограмма больного с внутрипредсердным опухолевым тромбом. Стрелки указывают на тромб
РКТ
В настоящее время является основным методом визуализации объемных образований почки. Точность РКТ в диагностике рака почки достигает 95%. РКТ довольно четко выявляет наличие венозной инвазии. Обычно рак почки визуализируется как мягкотканный узел, деформирующий корковый слой и проникающий в околопочечное пространство или полость лоханки. Контуры узла могут быть как четкими, ровными, так и нечеткими, волнистыми или бугристыми. В зависимости от степени васкуляризации опухоли ее внутренняя структура может быть различной: повышенной или пониженной плотности.
Как крупные, так и небольшие опухоли (1,5–2,0 см в диаметре) могут иметь некротические зоны и подвергаться кистозной трансформации, что обычно отчетливо отображается при РКТ. Внутренняя структура таких кистозных образований чаще всего неоднородна. Капсула подобных “кист” неравномерно утолщена, внутри нее или по ее поверхности могут определяться кальцинаты. Следует отметить, что при МРТ кальцинаты не визуализируются. Выявление кальцинатов в капсуле кистозных образований почек является настораживающим симптомом, часто свидетельствующим о наличии опухолевого процесса.
В/в контрастирование, несомненно, повышает диагностическую ценность РКТ в случаях, когда характер выявляемых образований или причина деформации почки не ясны. Если обнаруживаемое образование имеет иную степень контрастирования, чем смежная, внешне не измененная паренхима почки, это следует расценивать как признак опухолевого процесса.
Дифференциальная диагностика доброкачественных и злокачественных опухолей обычно невозможна, за исключением почечной ангиомиолипомы, патогномоничным признаком которой является наличие жировых включений.
Увеличение размеров, дефекты заполнения почечной вены указывают на ее вовлечение в опухолевый процесс. Одновременное контрастное усиление опухоли и крови в НПВ ограничивает использование РКТ для выявления венозной инвазии. Общая точность РКТ в диагностике опухолевого тромбоза составляет от 68 до 95% (рис. 9).

Рисунок 9. КТ больного раком правой почки с опухолевым тромбозом НПВ. Стрелка указывает на резко расширенную НПВ
МРТ
МРТ занимает важное место в диагностике объемных образований почек. Особенно это касается обследования больных с выраженным нарушением почечной функции, аллергическими реакциями на йодсодержащие контрастные растворы, противопоказаниями к ионизирующему излучению. Возможность получения многопланового изображения в различных плоскостях имеет большое значение для определения происхождения первичной опухоли, когда данные РКТ неоднозначны. Несмотря на высокую разрешающую способность, возможность многоплановой визуализации и оценки васкуляризации без контрастного усиления, применение МРТ в выявлении и диагностике малых опухолей почек ограничено из-за близкой интенсивности сигнала нормальной почечной паренхимы и рака почки в обоих Т1 и Т2 режимах. Тем не менее при использовании различных режимов точность МРТ в выявлении опухолей почки не уступает РКТ. Бесспорным достоинством МРТ является возможность хорошей визуализации протяженных трубчатых структур, таких как НПВ, что имеет огромное значение у больных с опухолевым тромбозом НПВ. Даже при полной окклюзии НПВ возможна четкая визуализация опухолевого тромба и точное определение его протяженности без применения контрастирования (рис. 10).

Рисунок 10. МРТ больного с опухолевым тромбом, достигающим правого предсердия. Стрелкой показана верхняя граница тромба
На сегодняшний день МРТ является методом выбора в диагностике опухолевого тромба и определения его верхней границы. Противопоказаниями к проведению МРТ являются клаустрофобия, наличие у больного пейсмекера, металлических протезов, хирургических металлических скрепок. Дополнительным ограничением является высокая стоимость метода.
АГ
АГ, ранее являвшаяся ведущим методом диагностики опухолей почек, в настоящее время выполняется только в случаях, когда требуется точная информация о количестве почечных артерий, сосудистой архитектонике почки, а также при подозрении на заинтересованность магистральных сосудов. Показаниями к АГ являются:
- Планируемая резекция почки.
- Опухоль почки больших размеров.
- Опухолевый тромбоз НПВ (рис. 11).
- Планируемая эмболизация почечной артерии.
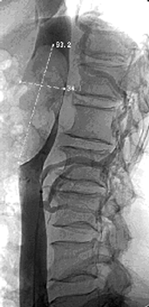
Рисунок 11. Кавограмма больного с опухолевым тромбом, достигающим диафрагмы
Наиболее важные лабораторные параметры у больных раком почки включают определение гемоглобина и СОЭ (прогностические факторы), креатинина (функциональное состояние почек), ЩФ (метастазы в печень, кости), сывороточного кальция (гиперкальциемия).
Хирургическое лечение локализованного рака почки
Хирургический подход и по сей день остается единственно эффективным в лечении рака почки. Роль хирургии за последние годы значительно изменилась по отношению как к локализованным формам, так и к диссеминированным. С одной стороны, значительно возросли показания к резекции почки в начальных стадиях болезни, с другой — в связи с появлением схем адъювантной иммунотерапии — увеличилась роль хирургии в лечении больных с метастазами и местнораспространенными формами опухолевого процесса.
Основной метод лечения рака почки — радикальная нефрэктомия, которая получила всеобщее признание после того, как в 1963 г. Robson опубликовал сравнительно хорошие результаты хирургического лечения. Принципы выполнения радикальной нефрэктомии мало изменились и включают:
— раннюю перевязку почечной артерии и вены;
— удаление почки вне фасции Герота вместе с окружающей паранефральной клетчаткой;
— удаление ипсилатерального надпочечника;
— выполнение регионарной лимфаденэктомии.
Наиболее важным аспектом является удаление почки вне фасции Герота, т.к. инвазия последней отмечается в 25% случаев. Современные исследования показали, что рутинное удаление надпочечника не всегда целесообразно, за исключением случаев, когда опухоль находится в верхнем полюсе или имеется субтотальное поражение почки. Несмотря на то, что лимфаденэктомия обеспечивает более точное стадирование, ее лечебная значимость остается спорной.
Показания к нефрэктомии
1. Радикальная нефрэктомия остается методом выбора в лечении локальных форм рака почки. Роль резекции почки при здоровой контралатеральной почке до конца не определена. Большинство исследователей склоняются к правомочности резекции при размерах опухоли не более 3–5 см.
2. Радикальная нефрэктомия показана больным раком почки с опухолевой инвазией почечной и нижней полой вены.
3. Радикальная нефрэктомия выполняется пациентам с солитарными метастазами в сочетании с одномоментной или последовательной резекцией последних.
4. Паллиативная нефрэктомия показана больным диссеминированным раком почки для уменьшения интоксикации, снижения интенсивности болевого синдрома, купирования профузной макрогематурии, а также пациентам, получающим лечение модификаторами биологического ответа.
При выполнении нефрэктомии по поводу рака почки предпочтение должно отдаваться трансперитонеальным доступам, среди которых наиболее универсальным является срединная лапаротомия. При больших опухолях верхнего полюса и планируемой резекции печени удобными являются односторонний или двухсторонний (Шеврона) подреберный доступ. В ряде случаев возможно применение торакоабдоминального доступа. Главными требованиями при любом доступе остаются быстрый выход на сосудистую ножку и возможность моноблочного экстрафасциального удаления почки с паранефральной клетчаткой.
Лимфаденэктомия при раке почки
Локализация лимфогенных метастазов
Распределение лимфогенных метастазов определяется особенностями лимфооттока. При наличии опухоли правой почки поражаются ретрокавальные, аортокавальные, латерокавальные и прекавальные лимфоузлы. Перекрестное метастазирование отмечается редко и практически всегда сочетается с наличием гомолатеральных лимфогенных метастазов.
Метастазы опухолей левой почки преимущественно локализуются в парааортальных лимфоузлах, поражение аортокавальных и контралатеральных лимфатических узлов отмечается редко. Иногда при отсутствии метастазов в регионарных лимфоузлах выявляется поражение отдаленных лимфоузлов.
Границы лимфаденэктомии
Лимфаденэктомия при раке почки подразумевает удаление всей жировой клетчатки с лимфатическими узлами, окружающей ипсилатеральные магистральные сосуды, от уровня ножек диафрагмы непосредственно ниже уровня отхождения верхней брыжеечной артерии, до бифуркации аорты и НПВ (рис. 12).
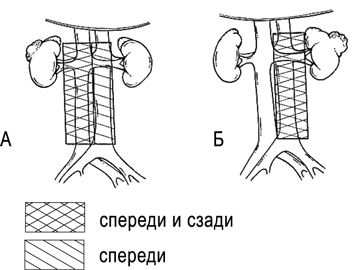
Рисунок 12. Границы расширенной лимфаденэктомии при раке правой (A) и левой (Б) почек
Клиническое значение лимфаденэктомии
Наличие метастазов рака почки в лимфатические узлы является одним из наиболее значимых неблагоприятных факторов прогноза. Появление регионарных метастазов снижает выживаемость больных до 5–30%. Теоретически удаление пораженных лимфатических узлов может улучшить результаты хирургического лечения.
Аляев Ю.Г. (1989) показал четкую корреляцию между стадией Т и наличием метастазов в лимфатических узлах. В связи с улучшением ранней диагностики рака почки частота обнаружения метастазов в неизмененных лимфоузлах уменьшилась с 30%, в наблюдениях времен Робсона, до 3,3%. Следовательно, клиническая значимость лимфодиссекции при раке почки значительно уменьшилась, по крайне мере, эпидемиологически. К сожалению, критериев отбора пациентов, которым показана лимфодиссекция, не существует. Основными аргументами в пользу выполнения лимфаденэктомии остаются точное стадирование и уменьшение частоты местных рецидивов. Для ответа на вопрос, улучшает ли расширенная лимфаденэктомия выживаемость больных раком почки, требуется завершение больших рандомизированных исследований (протокол EORTC № 30881).
Хирургическое лечение рака почки с опухолевым тромбозом почечной и нижней полой вены
Термин “венозная инвазия” означает распространение опухоли по просвету сосудов (продолженный рост) без обязательного прорастания сосудистой стенки. Синонимом понятия “опухолевая инвазия” является термин “опухолевый тромбоз”. Рак почки имеет тенденцию к формированию опухолевых тромбов с распространением последних по почечной и НПВ вплоть до правого предсердия. Венозная инвазия встречается у 4–10% больных, у 60% которых тромб распространяется выше устьев печеночных вен.
Опухолевый тромб чаще исходит из правой почки, что, возможно, связано с меньшей длиной правой почечной вены. Данные дооперационного обследования могут указывать на ретроградное распространение тромба по НПВ. Как правило, эта часть тромба представлена свернувшимися кровяными сгустками, а не опухолью. Опухолевый тромб может распространяться не только по почечной и НПВ, а также по печеночным, надпочечниковым и гонадным венам.
В зависимости от протяженности и отношения к печеночным венам выделяют 4 вида опухолевых тромбов НПВ:
— периренальные;
— субпеченочные;
— внутрипеченочные (ретропеченочные);
— надпеченочные.
Первые три вида относят к группе поддиафрагмальных тромбов. Надпеченочные, или наддиафрагмальные, тромбы подразделяют на внутриперикардиальные и внутрипредсердные. Уровень распространения тромба является важным фактором при выборе метода хирургического лечения.
Основным отличием тромбэктомии от просто радикальной нефрэктомии является необходимость мобилизации, контроля и резекции НПВ. Удаление тромба при его распространении на правое предсердие особенно опасно, и при некоторых видах тромбоза требуется кардиопульмональное шунтирование, гипотермия с остановкой кровообращения.
У больных без отдаленных метастазов радикальная нефрэктомия с тромбэктомией обеспечивает 5-летнюю выживаемость от 47 до 64%. Наличие метастазов в лимфатических узлах и отдаленных метастазов значительно ухудшают выживаемость, в то время как уровень распространения опухолевого тромба достоверно не влияет на прогноз. Следовательно, активный хирургический подход к больным с опухолевым тромбозом НПВ является эффективным методом лечения, а радикальное удаление тромба любой протяженности дает шанс на выздоровление большинству больных.
Осложнения радикальной нефрэктомии
Послеоперационные осложнения отмечаются у 2% больных.
Неспецифические осложнения
Включают острый инфаркт миокарда, сердечную недостаточность, нарушения мозгового кровообращения, тромбоэмболию ветвей легочной артерии, пневмонию, ателектазы, тромбофлебиты. Частота осложнений может быть значительно уменьшена при соблюдении определенных правил предоперационной подготовки, профилактике гипотензии во время операции, проведении адекватной заместительной инфузионной терапии, дыхательной гимнастики, ранней активазации, бинтовании нижних конечностей.
Специфические осложнения
Редким послеоперационным осложнением является формирование свища поджелудочной железы — как следствие ее повреждения во время операции. Послеоперационный период обычно сопровождается клиникой панкреатита и выделением сока поджелудочной железы по страховому дренажу. Отделяемое дренажа должно быть исследовано на содержание панкреатической амилазы. При неадекватном дренировании возможно скопление жидкости в забрюшинном пространстве с формированием панкреатической псевдокисты или абсцесса, которые визуализируются на РКТ и УЗКТ. Большинство фистул при хорошем дренировании закрываются самостоятельно.
Парез кишечника после нефрэктомии, как правило, разрешается на 3–4 сутки. Прием жидкости per os следует начинать после активизации перистальтики и самостоятельного отхождения газов. В редких случаях требуется установка назогастрального зонда.
Вторичное кровотечение сопровождается клиникой геморрагического шока, болью и пальпируемым вздутием живота, выделением крови по дренажу. Источником могут служить сосуды почечной ножки, надпочечника, брыжейки или незамеченные повреждения селезенки и печени. В подавляющем большинстве случаев для остановки кровотечения требуется релапаротомия.
Острая почечная недостаточность может развиться у больных после нефрэктомии, особенно после операций по удалению опухолевых тромбов, требующих пережатия контралатеральной почечной вены. Как правило, функция оставшейся почки восстанавливается, однако часто требуется перевод больного на временный гемодиализ.
Органосохраняющее лечение при раке почки
Показания
Резекция почки является методом выбора в случае двухстороннего опухолевого поражения или при единственной функционирующей почке. Показания к резекции могут быть расширены при наличии сопутствующей патологии (сахарный диабет) и патологических процессов в контралатеральной почке (мочекаменная болезнь, хронический пиелонефрит, нефросклероз). В редких случаях резекция почки выполняется при переходно-клеточном раке собирательной системы и при опухоли Вильмса, когда крайне необходимо сохранение функционирующей паренхимы.
В последние годы показания к органосохраняющему лечению еще более расширились в связи с ранней выявляемостью опухолей почки, когда их размеры не превышают 3–5 см. Предварительные результаты исследований, сравнивающих резекцию при здоровой контралатеральной почке и нефрэктомию, говорят о правомочности органосохраняющего подхода при небольших размерах опухоли и локализации, удобной для резекции.
Общие положения
Варианты органосохраняющего хирургического лечения при раке почки:
- Энуклеация опухоли.
- Клиновидная резекция почки.
- Резекция полюса почки.
- Геминефрэктомия.
- Экстракорпоральная резекция с аутотрансплантацией почки.
При любом виде резекции необходимо соблюдение следующих общих принципов:
— контроль за почечными сосудами;
— минимальное время ишемии;
— удаление опухоли в пределах здоровых тканей;
— герметичное ушивание вскрытой собирательной системы почки;
— тщательный гемостаз;
— укрывание дефекта почечной паренхимы мышечно-фасциальным, жировым или брюшинным лоскутом.
При планировании резекции почки большое значение имеет выполнение селективной почечной артериографии, за исключением случаев небольших опухолей, расположенных в области одного из полюсов почки. Знание сосудистой архитектоники почки, расположения главной почечной артерии и ее ветвей позволяют удалить опухоль с наименьшей кровопотерей и с сохранением максимального объема функционирующей паренхимы.
Осложнения
После резекции почки в основном связаны с техническими особенностями проведения хирургического вмешательства — мобилизацией почечных сосудов, длительностью их пережатия, объемом удаляемой почечной паренхимы, реконструкцией чашечно-лоханочной системы. Риск развития осложнений при периферически расположенных опухолях малого размера, как правило, незначителен. Наиболее частыми осложнениями являются:
— вторичное кровотечение;
— формирование мочевого свища;
— стриктура мочеточника, плохая функция резецированной почки;
— инфекционные осложнения.
Профилактикой мочевых свищей является тщательное ушивание вскрытой чашечно-лоханочной системы. Большинство свищей закрываются спонтанно, однако в некоторых случаях требуется установка мочеточникового стента. Инфекционные осложнения после резекции почки обычно разрешаются самостоятельно при адекватном дренировании и отсутствии мочевой инфекции. Одновременное выполнение нефрэктомии и резекции контралатеральной почки или симультанного органосохраняющего лечения с обеих сторон опасны в отношении развития острой почечной недостаточности (ОПН). Исключениями являются периферически расположенные опухоли малого размера, при которых риск развития осложнений, как правило, незначителен, что оправдывает в некоторых случаях выполнение одномоментных операций.
Хирургическое лечение солитарных и единичных метастазов рака почки
Солитарные метастазы рака почки или метастатическое поражение только одного органа имеет место только в 3–11% случаев. Частота появления солитарных метастазов в различных органах отличается от распределения множественных. Наиболее часто поражают�